喜讯:2016年高考真题——化学(江苏卷)第19题 共命中57分(3)2016-07-06 17:47:00 阅读 次 参与讨论()
|
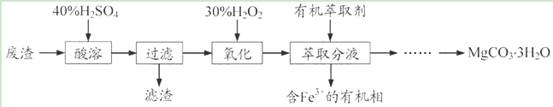
喜讯:2016年高考真题——化学(江苏卷)第19题 每题19分 共命中57分(3) 【高考真题】 二、选择题(本题共36分,每小题3分,每题只有一个正确选项) 19. (15分)实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
(1)酸溶过程中主要反应的热化学方程式为 MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1
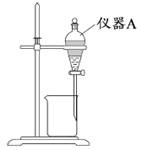
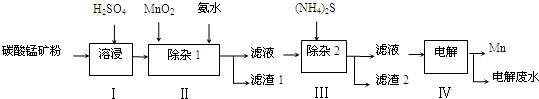
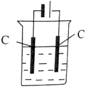
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。 (2)加入H2O2氧化时发生发应的离子方程式为___________。 (3)用右图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。 ①实验装置图中仪器A的名称为_______。 ②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。 (4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。 [已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。 【答案】(1)加快酸溶速率;避免制备MgCO3时消耗更多的碱 (2)H2O2+2Fe2++2H+=2Fe3++2H2O (3)①分液漏斗;②充分振荡 (4)至5.0<pH<8.5,过滤,边搅拌边向滤液中滴加Na2CO3溶液至有大量沉淀生成,静置,向上层清液中滴加Na2CO3溶液,若无沉淀生成, 【命中试题】 1. 【河北省邯郸市2016届高三第一次模拟考试理综化学试题 第28题】 (28)锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、 钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是_________________________________; (2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③________________; (3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是__________________; 加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。 (4)步骤Ⅲ中,需要用到的玻璃仪器除玻璃棒、漏斗外,还有_________;滤渣2的主要成分是_________; (5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.欲使溶液中c(Mn2+)≤1.0×10-5 mol•L-1,则应保持溶液中c(S2-)≥ _____ mol•L-1。 【答案】(14分)(1)MnCO3+H2SO4 =MnSO4+ CO2↑+H2O (3分,气体符号不扣分) (2)抑制Mn2+的水解 (2分) (3)MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O(3分) (4)烧杯(2分) CoS和NiS (每个1分,共2分) (5)1×10-6 mol·L-1 (2分) 2. 【山东省济南市2016届高三下学期3月一模考试理综化学试题 第27题】
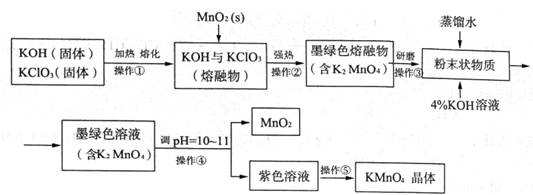
(28)高锰酸钾是常用的消毒剂、除臭剂、水质净化剂以及强氧化剂,下图是在实验室中制备KMnO4晶体的流程:
回答下列问题: (1)操作②目的是获得K2MnO4,同时还产生了KCl和H2O,试写出该步反应的化学方程式: _______________。操作①和②均需在坩埚中进行,根据实验实际应选择_______________(填序号)。 a.瓷坩埚 b.氧化铝坩埚 c.铁坩埚 d.石英坩埚 (2)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为_______________。若溶液碱性过强,则MnO4-又会转化为MnO42-,该转化过程中发生反应的离子方程式为_______________。因此需要通入某种气体调pH=10-11,在实际操作中一般选择CO2而不是HCl,原因是_______________。 (3)操作⑤过滤时,选择图2所示装置而不用图1所示装置的原因是_______________。
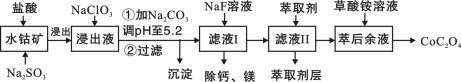
(4)还可采用电解K2MnO4溶液(绿色)的方法制造KMnO4(电解装置如图所示),电解过程中右侧石墨电极的电极反应式为_______________。溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能的原因是_______________。 【答案】(15分)(1)KClO3+3MnO2+6KOH (2)3MnO42- + 2H2O = 2MnO4- + MnO2↓+ 4OH-;4MnO4- +4OH- = 4MnO42- + O2↑+ 2H2O;Cl-具有还原性,可将K2MnO4和KMnO4还原;(3)过滤速度快、效果好; (4)MnO42- -e- = MnO4-;电解较长时间后,阳极产生的MnO4-在阴极被还原,紫色又转变为绿色。(或阴极上氢离子放电生成氢气,同时产生大量的氢氧根离子,溶液碱性增强,紫色又转变为绿色。) 3. 【河南省商丘市2016届高三4月份第二次模拟考试理科综合化学试题第28题】 (28)利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如下
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
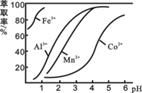
(1)浸出过程中加入Na2SO3的目的是_____________。 (2)制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为 ;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为 (标准状况)。 (3)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______(填选项序号)。
A.接近2.0 B.接近3.0 C.接近5.0 (4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c(Ca2+)=____。 (5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K ①当恰好形成正盐时,溶液中离子浓度的大小关系为 。 ②当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为 。 【答案】(1)将Co3+、Fe3+还原;(2) 3Cl2+6OH- (4)0.7;(5) ①c(NH4+) >c(SO32-)>c(OH-)>c(HSO3-)>c(H+);②HSO3-+ OH-= SO32-+ H2O;
|
网友评论
浙江省宁波市三锋教研联盟2023-2024学年高二下学期期中联考
浙江省宁波市三锋教研联盟2023-2024学年高二下学期期中联考
重庆市巴蜀中学2023-2024学年高三上学期适应性月考(五)
重庆市巴蜀中学2023-2024学年高三上学期适应性月考(五)