喜讯:2017年高考真题——化学(北京卷)第28题 共命中16分2017-06-28 14:54:00 阅读 次 参与讨论()
|
喜讯:2017年高考真题——化学(北京卷) 铁离子的性质命中16分 【高考真题】2017年高考真题——理综(北京卷)第28题 28.(16分)某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。 向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。 (1)检验产物 ①取出少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。 ②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。 (2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验: ①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
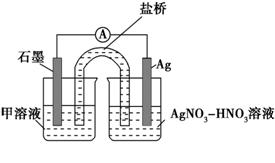
(资料:Ag+与SCN-生成白色沉淀AgSCN) ② 对Fe3+产生的原因作出如下假设: 假设a:可能是铁粉表面有氧化层,能产生Fe3+; 假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+; 假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+; 假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。 ③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。 实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。 实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。 【答案】 (1)①加硝酸加热溶解固体,再滴加稀盐酸,产生白色沉淀 ②Fe2+ (2)Fe+2Fe3+=3Fe2+ ②4Fe2++O2+4H+=4Fe3++2H2O 加入KSCN溶液后产生白色沉淀 ③0.05 mol·L-1 NaNO3溶液 FeSO4溶液 分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色更深 (3)溶液中存在反应:①Fe+2Ag+=Fe2++2Ag ,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+。反应开始时,c(Ag+)大,以反应①、②为主,c(Fe3+)增大。约30分钟后,c(Ag+)小,以反应③为主,c(Fe3+)减小。 【命中试题一】天津市南开区2017届高考二模化学试卷 Word版含答案/down/2017-5/12/2692418.shtml 9.(18分)某班同学用如下实验探究Fe2+、Fe3+的性质。 请回答下列问题: (1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol·L-1的溶液.在FeCl2溶液中需加入少量铁屑,其目的是 。 (2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红, 说明Cl2可将Fe2+氧化。 FeCl2溶液与氯水反应的离子方程式为: 。 (3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是 。 (4)丙组同学取l0mL0.l mol·L-1KI溶液,加入6 mL0.l mol·L-1 FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验: ①第一支试管中加入lmLCCl4充分振荡、静置, CCl4层显紫色; ②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀: ③第三支试行中加入1滴KSCN溶液,溶液变红。 实验②检验的离子是(填离子符号) ;实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号) ,由此可以证明该氧化还原反应为 。 (5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为 ;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是 ;生成沉淀的原因是(用平衡移动原理解释) 。 (6)戊组同学模拟工业上用NaClO3氧化酸性FeCl2废液制备FeCl3。 ①若酸性FeCl2 废液中:c(Fe2+)=2.0×10-2 mol·L-1,c(Fe3+)=1.0×10-3 mol·L-1,c(Cl-)=5.3×10-2 mol·L-1,则该溶液的pH约为 。 ②完成NaClO3氧化FeCl2的离子方程式: □ClO3-+□Fe2++□ =□Cl-+□Fe3++□ ③FeCl3具有净水作用,其原理是 。 【答案】(1)防止Fe2+被氧化 (1分) (2)2Fe2++Cl2=2Fe3++2Cl- (2分) (3)隔绝空气(排除氧气对实验的影响) (1分) (4)Fe2+ Fe3+可逆反应(各1分,共3分) (5)2Fe2++H2O2+2H+=2Fe3++2H2O (2分) Fe3+催化H2O2分解产生O2 (1分) H2O2分解反应放热,促进Fe3+的水解平衡正向移动 (2分) (6)①2 (2分) ②1 6 6H+ 1 6 3H2O (2分) ③Fe3+水解产生的Fe(OH)3胶体粒子能吸附水中悬浮的杂质 (2分)
|
网友评论
浙江省宁波市三锋教研联盟2023-2024学年高二下学期期中联考
浙江省宁波市三锋教研联盟2023-2024学年高二下学期期中联考
重庆市巴蜀中学2023-2024学年高三上学期适应性月考(五)
重庆市巴蜀中学2023-2024学年高三上学期适应性月考(五)