喜讯:2019年高考真题——理综化学(全国卷Ⅰ)第28题(命中65分)(1)2019/7/30 9:55:00 阅读 次 参与讨论()
|
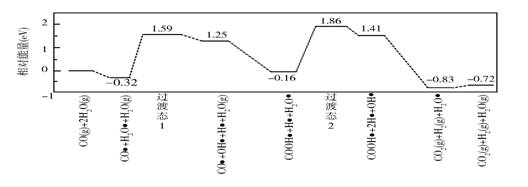
喜讯:2019年高考真题——理科综合(全国卷Ⅰ) 【高考真题】2019年高考真题——理科综合(全国卷Ⅰ) 第28题 https://www.ks5u.com/down/2019-6/9/3700680.shtml 28.(14分) 水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题: (1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。 ②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。 根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。 (2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。 A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50 (3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。 (4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
计算曲线a的反应在30~90 min内的平均速率 【答案】 (1)大于 (2)C (3)小于 2.02 COOH*+H*+H2O*===COOH*+2H*+OH*(或H2O*=== H*+OH*) (4)0.0047 b c a d 【命中试题1】14分 江苏省苏锡常镇四市2019届高三二模考试(十一)化学试卷 Word版含答案https://www.ks5u.com/down/2019-7/12/3734172.shtml 20. (14分)铁及其化合物在生产、生活中有广泛的应用。 (1)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下: ①MnFe2O4(s)===MnFe2O(4-x)(s)+O2(g) ΔH1 ②MnFe2O(4-x)(s)+xH2O(g)===MnFe2O4(s)+xH2(g) ΔH2
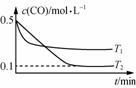
则:ΔH3与ΔH1、ΔH2的关系为ΔH3=________。 (2)纳米铁是重要的储氢材料,可用下列反应制得:Fe(s)+5COFe(CO)5(g) ΔH<0。在1 L恒容密闭容器中加入足量铁粉和0.5 mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图1所示。图1
①T1________(填“>”或“<”)T2。 ②T2温度下,上述反应的平衡常数K=________(结果不要求带单位)。 (3)高铁酸钾(K2FeO4)被人们称为“绿色化学”净水剂。高铁酸钾在酸性至弱碱性条件下不稳定。 ①工业上用KClO与Fe(NO3)3溶液反应制得K2FeO4,反应的离子方程式为________________________________________。制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液混合的操作为________________________。 ②已知K2FeO4在水解过程中铁元素形成的微粒分布分数与pH的关系如图2所示。
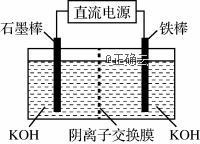
图2图3 向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为____________________________________。 (4) 电解法可制得K2FeO4,装置如图3所示。阳极的电极反应式为______________________________________。 【答案】 (1) (2分) (2) ①>(2分) ②8×103(2分) (3) ①3ClO-+2Fe3++10OH-===2FeO+3Cl-+5H2O(2分) 在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中(2分) ②HFeO+OH-===FeO+H2O(2分) (5) Fe-6e-+8OH-===FeO+4H2O(2分) (6)
【命中试题2】12分 江苏省苏锡常镇四市2019届高三二模考试(十一)化学试卷+Word版含答案https://www.ks5u.com/down/2019-7/12/3734172.shtml 21. (12分) A. [物质结构与性质] 高温炼铜的反应之一为2CuFeS2+O2Cu2S+2FeS+SO2。 (1) Cu+基态核外电子排布式为________________。
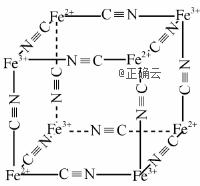
(2) Cu、Zn的第二电离能:I2(Cu)________(填“>”“<”或“=”)I2(Zn)。 (3) SO2分子中S原子的轨道杂化类型为________,分子的空间构型为________,与SO2互为等电子体的分子有________(写一种)。 (4) [Cu(CH3CN)4]+是非常稳定的络合离子,配体中σ键和π键个数之比为________。 (5) Fe2+、Fe3+能与CN-络合,其结构如图所示。该离子可形成铁蓝钾盐,该钾盐的化学式为________。 【答案】 A. [物质结构与性质] (1) [Ar]3d10 (2) > (3) sp2 V形 O3 (4) 5∶2 (5) KFeFe(CN)6 【命中试题3】12分 江苏省苏锡常镇四市2019届高三二模考试(十一)化学试卷+Word版含答案https://www.ks5u.com/down/2019-7/12/3734172.shtml
B. [实验化学] 8羟基喹啉( ①如图1所示,在三颈烧瓶中加入适量甘油、邻硝基苯酚、邻氨基苯酚和浓硫酸。
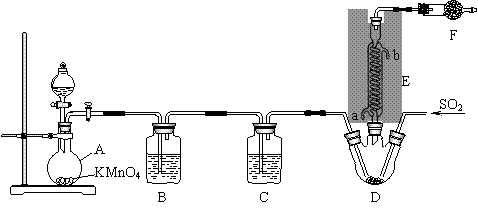
图1图2 ②加热至反应自动激烈进行。 ③改为水蒸气蒸馏装置进行水蒸气蒸馏,直至馏出液中不再有油珠为止。 ④向三颈烧瓶中加入一定量NaOH溶液后,再滴加饱和Na2CO3溶液将pH调至7~8。 ⑤重新进行水蒸气蒸馏,至馏出液中不再有晶体析出。 ⑥将馏出液充分冷却后抽滤,进一步精制得产品。 (1)图1中冷却水应从________(填“A”或“B”)口进。 (2)图2是水蒸气发生装置。第一次水蒸气蒸馏的目的是___________________________________; 当冷凝管出现堵塞时,图2中可观察到的现象是_________________________________________。 (3)抽滤装置中,布氏漏斗进入抽滤瓶的部分不宜过长,其原因是________________________________。 (4)步骤②中移开火源,反应仍自动激烈进行的原因是__________________________________。 (5)步骤④中加入的饱和Na2CO3溶液不能过量的原因是__________________________________。 【答案】 B. [实验化学] (1) A(2分) (2) 将未反应的反应物等蒸出(2分) 玻璃管中水位上升(2分) (3) 防止滤液吸入抽滤瓶支管而进入减压系统(2分) (4) 反应放出大量的热(2分) (5) 如果饱和Na2CO3溶液过量,则酚羟基也要与Na2CO3反应生成钠盐(2分) 【命中试题4】12分 辽宁省本溪高级中学2019届高三二模考试化学试卷+Word版含答案https://www.ks5u.com/down/2019-7/11/3731731.shtml 21、硫酰氯(SO2Cl2)是一种重要的化工试剂,氯化法是合成硫酰氯(SO2Cl2)的常用方法。 实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):
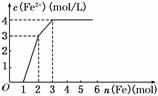
已知:① SO2(g) + Cl2(g)=SO2Cl2(l) ΔH=-97.3 kJ/mol。 ② 硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。 ③ 100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。 回答下列问题: (1) 装置A中发生反应的离子方程式为。 (2) 装置B的作用为,若缺少装置C,装置D中SO2与Cl2 还可能发生反应的化学方程式为。 (3) 仪器F的名称为,E中冷凝水的入口是(填“a”或“b”), F的作用为。 (4) 当装置A中排出氯气1.12 L(已折算成标准状况)时,最终得到5.4 g纯净的硫酰氯,则硫酰氯的 产率为。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项 有(填序号)。 ① 先通冷凝水,再通气 ② 控制气流速率,宜慢不宜快 ③ 若三颈烧瓶发烫,可适当降温 ④ 加热三颈烧瓶 (5) 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2 + H2SO4,分离产物的方法是 A.重结晶 B.过滤 C.蒸馏 D.萃取 (6) 长期存放的硫酰氯会发黄,其原因可能为。 【答案】 (1) 2MnO4— + 10Cl— + 16H+=2Mn2+ + 5Cl2↑+ 8H2O( 1分) (2) 除去HCl ( 1分) SO2 + Cl2 + 2H2O=2HCl + H2SO4( 2分) (3) 球形干燥管 ( 1分) a( 1分) 防止空气中的水蒸汽进入;吸收尾气,防治污染空气( 2分) (4) 80% ( 1分) ①②③( 2分) (5) (5) C ( 1分) (6) 硫酰氯分解产生氯气溶解在硫酰氯中导致其发黄( 1分) 【命中试题5】5分 辽宁省大连市第四十八中学2019届高三5月模拟化学试卷+Word版含答案https://www.ks5u.com/down/2019-7/4/3724424.shtml 23.(5分)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中 Fe2+浓度和加入铁粉的物质的量之间的关系如图所示,则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为 按反应的先后顺序写出该过程的离子反应方程式: 【答案】1:1:4 Fe+4H++NO3-= Fe3++NO↑+2H2O 2 Fe3++ Fe=3 Fe2+ Cu 2++ Fe=Fe2++Cu
【命中试题6】10分 辽宁省大连市第四十八中学2019届高三5月模拟化学试卷+Word版含答案https://www.ks5u.com/down/2019-7/4/3724424.shtml 25.(10分)FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。 Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性; ②通入干燥的Cl2,赶尽装置中的空气; ③用酒精灯在铁屑下方加热至反应完成; ④…… ⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。 请回答下列问题: (1)装置A中反应的化学方程式为。 (2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端要使沉积的FeCl3进入收集器,第④步操作是。 (3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)。 (4)装置B中冷水浴的作用为;装置C的名称为;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:。 (5)在虚线框中画出尾气吸收装置E并注明试剂。 Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。 (6)FeCl3与H2S反应的离子方程式为。 (7)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点: ①H2S的原子利用率为100%;②。 【答案】 (1)2Fe+3Cl2 (2)在沉积的FeCl3固体下方加热 (3)②⑤ (4)冷却,使FeCl3沉积,便于收集产品干燥管 K3[Fe(CN)6)溶液 (5) (6)FeCl3与H2S反应的离子方程式为 2Fe3++H2S=2Fe2++S↓+2H+ (7)FeCl3得到循环利用
|
网友评论
浙江省宁波市三锋教研联盟2023-2024学年高二下学期期中联考
浙江省宁波市三锋教研联盟2023-2024学年高二下学期期中联考
重庆市巴蜀中学2023-2024学年高三上学期适应性月考(五)
重庆市巴蜀中学2023-2024学年高三上学期适应性月考(五)